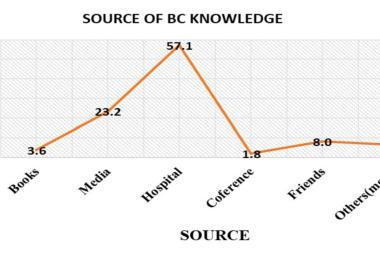
Abstrak
Penyakit Alzheimer berkait dengan peningkatan kematian sel neuron dan gangguan fungsi kognitif. Penyakit ini dicirikan oleh pembentukan plak di otak. Pengumpulan peptida beta amiloid (Aβ) dipercayai merupakan penanda awal kepada patofisiologi penyakit Alzheimer. Walau bagaimanapun, mekanisma toksisiti Aβ masih tidak diketahui tetapi mungkin melibatkan peningkatan tekanan oksidatif. Oleh itu, kajian ini dijalankan untuk menentukan kesan toksik Aβ terhadap DNA - biomolekul penting yang dioksidakan oleh radikal bebas, dan apoptosis sel serta modulasinya oleh fraksi kaya tokotrienol (TRF), sejenis antioksidan. Sel titian neuroblastoma diperlakukan sama ada dengan 10μM peptida Aß, 5mg/ml TRF diikuti dengan 10μM peptida Aß atau 10μM peptida Aß peptide diikuti dengan 5mg/ml TRF. Sel yang tidak dperlakukan dengan Aß atau TRF dijadikan sebagai kawalan. Kerosakan DNA ditentukan dengan menggunakan asai komet, viabiliti sel ditentukan menggunakan asai 3-(4,5-dimetiltiazol-2-il)-5-(3-karboksimetoksifenil)2-(4-sulfofenil)-2H-tetrazolium (MTS) dan pewarnaan propidium iodida dan calcein-AM dijalankan untuk menentukan bilangan sel yang hidup dan sel yang mengalami apoptosis. Keputusan menunjukkan bahawa peptida Aß meningkatkan kerosakan DNA secara signifikan berbanding kawalan (p<0.05) dan meningkatkan kematian sel. Walau bagaimanapun, perlakuan dengan TRF mengurangkan kerosakan DNA secara signifikan, meningkatkan bilangan sel hidup dan mengurangkan jumlah sel yang mengalami apoptosis berbanding kumpulan yang diaruh oleh peptida Aß sahaja (p<0.05). Oleh itu, kajian ini menujukkan peptida Aß menyebabkan kerosakan DNA dan kematian sel melalui apoptosis kemungkinan disebabkan oleh aruhan kerosakan oksidatif pada DNA. Ini disokong oleh fakta di mana TRF, suatu antioksidan, berupaya melindungi kerosakan DNA dan apoptosis.
Kata Kunci :
apoptosis,
Kerosakan DNA,
neurodegenerasi,
penyakit Alzheimer,
peptida beta amiloid,
TRF,